Tüm Neandertallerin, diğer türlerde bulunmayan belirli bir AMPD1 varyantını taşıdığını buldular. Bu varyanta sahip laboratuvarda üretilen enzimler AMPD1 aktivitesinde %25 oranında azalma gösterdi. Genetiği değiştirilmiş farelere verildiğinde kas dokusunda azalma yüzde 80’lere ulaşıyor ve enzim fonksiyonunu bozuyor. Araştırmacılar ayrıca modern insanların bu varyantı, yaklaşık 50 bin yıl önce modern insanlarla karşılaşmadan önce Avrupa ve Batı Asya’da yaşayan Neandertallerle çiftleşme yoluyla miras aldığını ortaya koydu.
Daha fazlasını okuYapay Zeka, Arkelerde Potansiyel Antimikrobiyal Aktiviteye Sahip Yeni Moleküller Buldu.
Hem bakterilerden hem de ökaryotlardan (bitkiler, hayvanlar ve mantarlar dahil) farklı olarak Arkeler, yaşam ağacında kendilerine ait bir dalda yer alırlar.
Arkeler mikroskop altında bakterilere benzeseler de genetik, hücre zarı ve biyokimya açısından temelde birbirlerinden farklıdırlar.
Bu farklılıklar, onların aşırı sıcak deniz altı bacalarından Yellowstone Milli Parkı’ndaki gibi kavurucu sıcak su kaynaklarına kadar Dünya’nın en uç ortamlarında hayatta kalmalarını sağlıyor.
Arkeler, diğer organizmaların çok azının gelişebildiği yerlerde, yani ezici basınçlara, zehirli kimyasallara ve aşırı sıcaklıklara dayanabildikleri için, biyolojileri alışılmadık şekillerde evrimleşmiştir.
Bu, onları antibiyotikler gibi işlev görebilen ancak şu anda kullanımda olanlardan farklı şekilde çalışan bileşikler de dahil olmak üzere, yeni moleküler araçların umut verici ancak büyük ölçüde keşfedilmemiş bir kaynağı haline getiriyor.
Daha fazlasını okuOkyanusta plastik yiyen bakteri keşfedildi…
Çalışmanın eş lideri ve deniz ekolojisti Carlos Duarte, “M5 motifi, bir PETaz enziminin ne zaman işlevsel hale gelip PET plastiği parçalayabileceğini bize söyleyen bir parmak izi gibi davranıyor,” diye açıklıyor. “Keşfi, bu enzimlerin diğer hidrokarbon parçalayıcı enzimlerden nasıl evrimleştiğini anlamamıza yardımcı oluyor,” diyor. “Karbonun kıt olduğu okyanuslarda, mikroplar bu enzimleri, insan yapımı bu yeni karbon kaynağı olan plastiği kullanmak için ince ayar yapmış gibi görünüyor.”
Daha fazlasını okuKüçük moleküller glokomu körlüğe yol açmadan önce durdurabilir..
Biyobelirteçler ve Koruyucu Tedaviler Aranıyor
Mizzou Tıp Fakültesi’nde araştırmacı olan Pawan Singh, hem glokomu erken teşhis eden biyobelirteçleri hem de optik siniri koruyan tedavileri bulmaya kendini adamıştır. Ekibi yakın zamanda, glokom hastalarının, gözün ön kısmındaki berrak sıvıda, doğal olarak oluşan iki molekül olan agmatin ve tiaminin, hastalığı olmayan bireylere kıyasla daha düşük seviyelerde olduğunu keşfetti. Metabolit olarak bilinen bu küçük moleküller, testlerle tespit edilebilen erken göstergeler olarak işlev görebilir.
Daha fazlasını oku2025 Nobel Tıp Ödülü: İmmün Tolerans Keşfi ile Brunkow, Ramsdell ve Sakaguchi’ye Verildi..
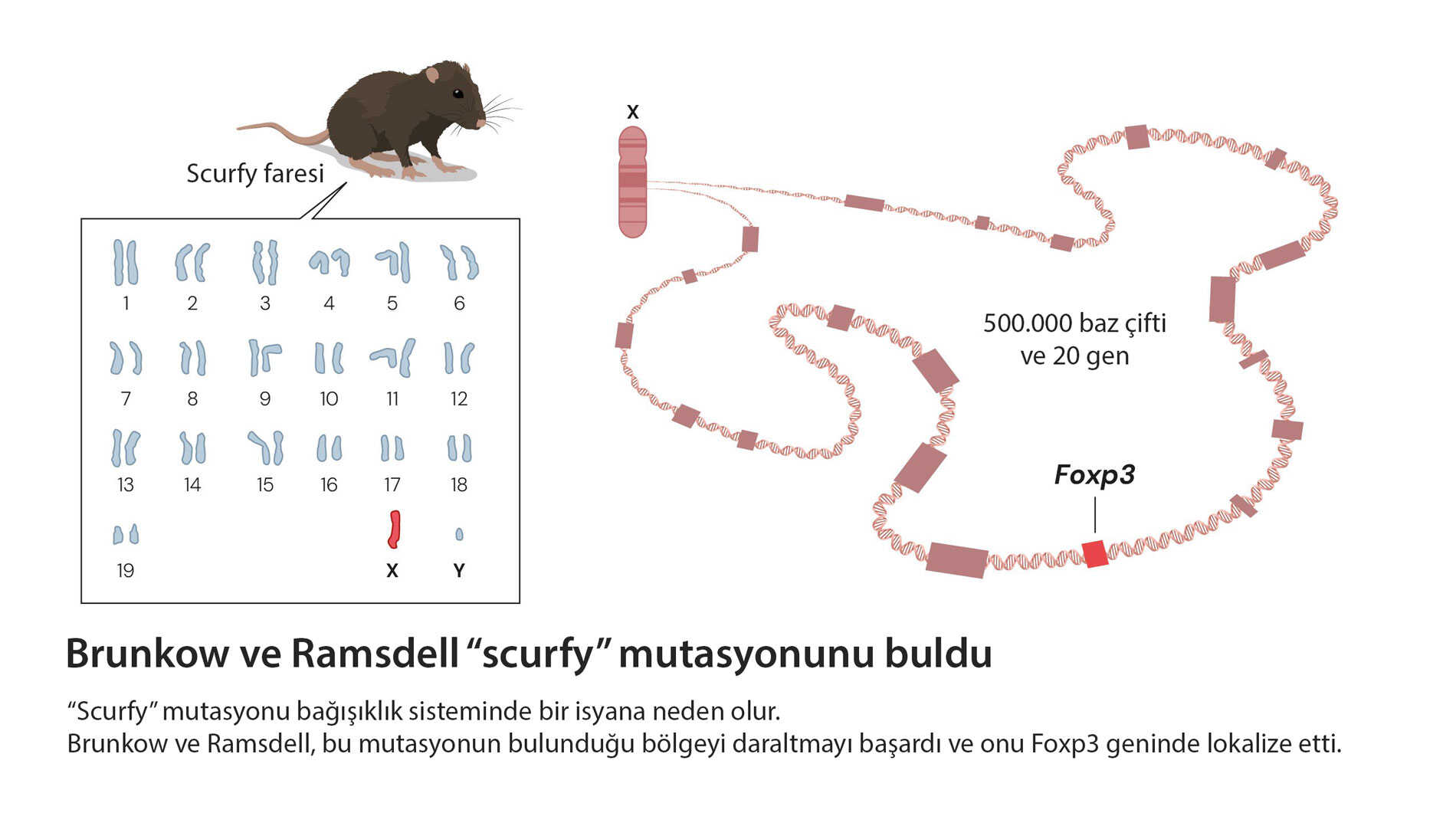
1995’te Kırılma: CD4⁺CD25⁺ Düzenleyici T Hücreleri
Uzun ve titiz bir ayrımlama sürecinden sonra Sakaguchi, CD4⁺ T hücrelerinin içinde CD25 taşıyan özel bir alt grup tanımladı: düzenleyici T hücreleri (Treg). Bu hücreler, klasik yardımcı T hücrelerinden farklı olarak immün yanıtı frenliyor, aşırılığı yatıştırıyor ve “kendine saldırı” riskini azaltıyordu (J Immunol, 1995).
Daha fazlasını okuDNA için “Google”: MetaGraph genetik verileri saniyeler içinde tarıyor…

Nadir genetik hastalıkların tespiti ve tümörlere özgü mutasyonların belirlenmesi artık mümkün. Bu başarı, yıllar önce biyomedikal araştırmalarda devrim yaratan DNA dizileme teknolojileri sayesinde elde edildi. Özellikle son dönemde geliştirilen yeni nesil dizileme (NGS) yöntemleri, genetik araştırmalarda büyük bir veri patlamasına yol açtı.
Amerikan Sequence Read Archive (SRA) ve Avrupa’daki European Nucleotide Archive (ENA) gibi dev veri merkezlerinde artık toplamda yaklaşık 100 petabayt genetik bilgi bulunuyor. Bu miktar, internetteki tüm metin verilerine eşdeğer. Ancak bu kadar büyük bir veriyi aramak bugüne kadar son derece maliyetli ve zaman alıcıydı.
Daha fazlasını okuMetforminin gizli beyin yolu 60 yıl sonra ortaya çıktı.
Metformin, 60 yılı aşkın süredir tip 2 diyabetin tedavisinde başvurulan ilk ilaç olmasına rağmen, araştırmacılar hala nasıl çalıştığına dair tam bir fikre sahip değiller. Baylor Tıp Fakültesi’ndeki bilim insanları ve uluslararası işbirlikçiler, metforminin klinik açıdan önemli etkilerine aracılık eden, daha önce bilinmeyen yeni bir etken keşfettiler: beyin. Metforminin anti-diyabetik etkisinde rol oynayan bir beyin yolunu ortaya çıkaran araştırmacılar, diyabetin daha etkili ve hassas bir şekilde tedavi edilmesi için yeni olasılıklar keşfettiler. Çalışma, Science Advances dergisinde yayınlandı .
“Metforminin kan şekerini öncelikle karaciğerdeki glikoz çıkışını azaltarak düşürdüğü yaygın olarak kabul görmüştür. Diğer çalışmalar ise bağırsaklar üzerinden etki ettiğini göstermiştir,” diyor Baylor Üniversitesi’nde pediatri ve beslenme alanında doçent olan ilgili yazar Dr. Makoto Fukuda. “Beynin, tüm vücut glikoz metabolizmasının temel düzenleyicisi olarak yaygın olarak kabul edildiği için onu inceledik. Beynin, metforminin anti-diyabetik etkilerine nasıl katkıda bulunduğunu araştırdık.”
Ekip, beynin ventromedial hipotalamus (VMH) olarak bilinen belirli bir bölgesinde bulunan Rap1 adlı küçük bir proteine odaklandı. Araştırmacılar, metforminin klinik açıdan önemli dozlarda kan şekerini düşürme yeteneğinin, bu beyin bölgesindeki Rap1’i kapatmaya bağlı olduğunu keşfetti.
Bunu test etmek için Fukuda laboratuvarı ve meslektaşları, VMH’lerinde Rap1 bulunmayan genetiği değiştirilmiş fareler kullandılar. Bu farelere tip 2 diyabeti taklit etmek için yüksek yağlı bir diyet uygulandı. Düşük dozda metformin verildiğinde, ilaç kan şekerlerini düşürmede başarısız oldu. Ancak insülin ve GLP-1 agonistleri gibi diğer diyabet ilaçları hala işe yarıyordu.
Kaynak ve devamına
Kaynak ve devamına Buradan ulaşabilirsin.
Kanser immünoterapisi için in vivo dendritik hücre yeniden programlaması.
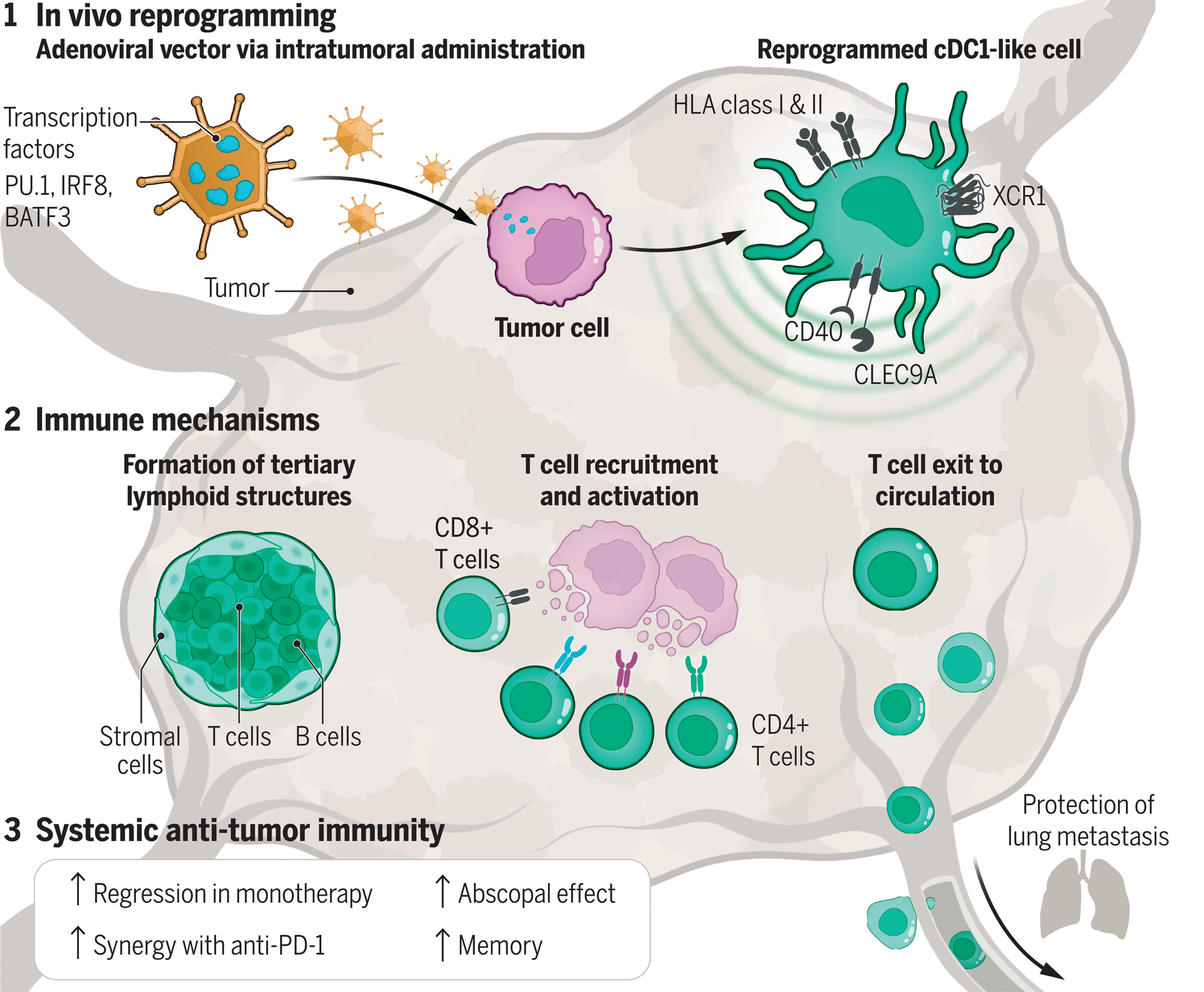
Tümör hücrelerinin cDC1 benzeri hücrelere yeniden programlanmasının, tümör mikroçevresinde tamamen canlı organizmada gerçekleşebileceği hipotezini öne sürüldü. Bu yaklaşım, cDC1’in benzersiz işlevlerinden yararlanarak T hücresi aktivasyonunu destekleyecektir. Singeneik modeller, ksenograftlar ve çeşitli kanser türlerinden elde edilen insan kanser sferoidlerinin bir kombinasyonunu kullanarak, yeniden programlamanın tetiklediği lokal ve sistemik bağışıklık tepkilerini karakterize edildi ve PIB’yi doğrudan tümörlere iletmek için bir viral platform geliştirildi.
In vivo tümör hücresi yeniden programlaması, in vitro yaklaşımlara kıyasla daha hızlı kinetik ve daha yüksek doğruluk gösterdi ve olgun, immünojenik bir imza gösteren tümör yerleşik cDC1 benzeri hücrelerle sonuçlandı. İmmünsüpresif kanser ilişkili fibroblastların, miyeloid kökenli baskılayıcı hücrelerin veya perisitlerin varlığına rağmen insan kanser kürelerinde yeniden programlama etkili bir şekilde ilerledi ve T hücresi aktivasyonuna ve tümör hücresi eliminasyonuna yol açtı.
Kaynak ve devamına Buradan ulaşabilirsin.
Yale Araştırmacıları Metabolizmayı Görüntülemek İçin Yeni Bir Platform Geliştiriyor…
Kütle izotopomer çoklu koordinat spektral analizi (MIMOSA), ayrı glikolitik ve mitokondriyal metabolik hızları ölçmek için adım adım bir akı analiz platformudur. Daha da önemlisi, doğrudan sitrat sentez hızları, mitokondriyal asetil-CoA, oksaloasetat ve sitratın pozisyona özgü zenginleştirmeleri için [U-13C6]-D-glikoz etiketlemesinden üretilen kütle spektrumlarının dekonvolüsyonu ile elde edilmiştir
13C’nin ardışık öncüllerden ürünlerine pozisyona özgü transferinden, önemli metabolik hızların (pirüvat dehidrojenaz, β-oksidasyon, pirüvat karboksilaz, izositrat dehidrojenaz ve PEP/pirüvat döngüsü) kapsamlı sabit durum ve dinamik analizleri hesaplanmıştır. Önceki tekniklerin önemli sınırlamaları belirlenmiştir. INS-1 hücrelerinde sitrat sentaz hızları hem insülin salgılanması hem de oksijen tüketimi ile korelasyon göstermiştir. Pirüvat karboksilaz oranları daha önce bildirilenlerden önemli ölçüde düşüktü, ancak glikoz uyarımına yanıt olarak en yüksek kat değişimi gösterdi. Sonuç olarak, MIMOSA, metabolitler arasında
13 C etiketinin öncül/ürün pozisyonuna özgü transferinden kaynaklanan temel metabolik hızları ölçer ve glikoz oksitleyen tüm hücrelere geniş bir uygulama alanına sahiptir.
Kaynak ve devamına Buradan ulaşabilirsin.
Hücresel pan-zincir asil-CoA profili, mitokondriyal CoA ithalatı ve metabolizmasında SLC25A42/SLC25A16’yı ortaya koyuyor…
Esansiyel kofaktör koenzim A (CoASH) ve tiyoester türevleri (asil-CoA’lar), hücre metabolizmasında önemli rollere sahiptir. Bununla birlikte, farklı asil-CoA’ların, bölgeye özgü reaksiyonları desteklemek için farklı hücre içi bölmelere doğru bir şekilde nasıl bölündüğü ve bu bölmelendirmenin fizyolojik etkisi henüz tam olarak anlaşılamamıştır. Burada, kültürlenmiş insan hücrelerinden 33 hücresel ve 23 mitokondriyal asil-CoA’nın güvenilir bir şekilde tespit edilmesini sağlayan optimize edilmiş bir sıvı kromatografisi-kütle spektrometrisi tabanlı pan-zincir asil-CoA ekstraksiyon ve profilleme yöntemini bildiriyoruz. SLC25A16 ve SLC25A42’nin serbest CoASH’in mitokondriye ithalatı için kritik olduğunu ortaya koyuyoruz. Bu CoASH ithalat süreci, zenginleştirilmiş bir mitokondriyal CoA havuzunu ve yüksek akışlı TCA döngüsü ve yağ asidi oksidasyonu da dahil olmak üzere matristeki CoA’ya bağlı yolları destekler.
Kaynak ve devamına Buradan ulaşabilirsin.