Soyut
Polikistik over sendromu (PKOS), hem üreme hem de metabolik işlevleri etkileyen yaygın bir endokrin rahatsızlıktır. Kapsamlı araştırmalara rağmen, PKOS’un kesin nedenleri hala belirsizliğini korumaktadır. Son çalışmalar, gen ekspresyonunu düzenleyen küçük, kodlamayan RNA’lar olan mikroRNA’ların (miRNA’lar) PKOS’u anlamak için kritik öneme sahip olabileceğini göstermektedir.
Bu derleme makalesi, PKOS tanısı almış bireylerde hücre dışı sıvılardaki miRNA ekspresyonundaki farklılıkları incelemekte, tanısal biyobelirteç olarak kullanılabilirliklerini değerlendirmekte ve hastalığın altında yatan mekanizmalardaki rollerini belirlemektedir. İlgili raporlar, miRNA ekspresyon profillerinin PKOS hastaları ve sağlıklı bireyler arasında önemli farklılıklar gösterdiğini göstermektedir. Bazı miRNA’lar, foliküler gelişim, steroidogenez, insülin sinyali ve metabolik yollar gibi temel biyolojik süreçlerde düzensizlik göstermektedir. Bu sonuçlar, miRNA’ların PKOS ile bağlantılı hormonal dengesizliklere ve metabolik sorunlara yol açabileceğini düşündürmektedir. PKOS’lu hastalarda görülen miRNA ekspresyonundaki farklılıklar, bu miRNA’ların hastalığın erken teşhisi ve karakterizasyonu için biyobelirteç olarak olası rollerini vurgulamaktadır. miRNA tabanlı tanı ve tedavi stratejilerine yönelik araştırmaların devam etmesi, PKOS’a ilişkin anlayışımızı artırabilir ve daha kesin tedavi alternatiflerinin geliştirilmesini kolaylaştırabilir.
1. Giriş
Polikistik over sendromu (PKOS), üreme çağındaki kadınların %8-13’ünü etkileyen yaygın bir endokrin rahatsızlıktır ve vakaların yaklaşık %70’i teşhis edilememektedir. Anovülasyon ve kısırlığın başlıca nedenlerinden biridir ve uzun vadeli sağlık komplikasyonlarıyla ilişkilidir [ 1 , 2 ]. Teşhislerin çoğu 20-30 yaşları arasında konulmaktadır ve bu rahatsızlık ailevi örüntüler ve etnik farklılıklar göstererek 5 ila 6 kadından 1’ini etkilemektedir.
Kapsamlı araştırmalara rağmen, PKOS’un kesin etiyolojisi hala belirsizliğini korumaktadır. Gelişiminde genetik yatkınlık, çevresel etkiler, hormonal dengesizlikler ve metabolik faktörlerin rol oynadığı düşünülmektedir. PKOS’un altında yatan patofizyolojik mekanizmalar arasında kronik düşük dereceli inflamasyon, insülin direnci ve hiperandrojenizm yer alır; bunlar normal yumurtalık fonksiyonunu bozar ve tip II diyabet ve endometriyal kanser dahil olmak üzere eşlik eden hastalık riskini artırır [ 5 , 6 ]. Bu sendromun tedavisi söz konusu olduğunda, bilimsel raporlar farklı biyolojik ve terapötik faktörlere odaklanmıştır.
Mevcut tanı yöntemleri klinik bulgulara, ultrason görüntüleme ve hormon seviyesi değerlendirmelerine dayanmaktadır [ 6 ]. Ancak, PKOS’un heterojen yapısı, evrensel olarak kabul görmüş bir tanı kriteri oluşturmada zorluklar yaratmaktadır. Rotterdam kriterleri, tanı için en azından iki karakteristik özelliğin varlığını gerektiren en yaygın kullanılan kriterler olmaya devam etmektedir: yumurtalık kistleri, hiperandrojenizm (biyolojik veya klinik) ve düzensiz adet döngüleri.
PKOS’un karmaşıklığı göz önüne alındığında, daha hassas tanı araçlarına olan ihtiyaç artmaktadır. Son araştırmalar, moleküler biyobelirteçlerin, özellikle dolaşımdaki mikroRNA’ların (miRNA’lar), PKOS’un patofizyolojisine yeni bakış açıları sunabileceğini ve erken teşhisi iyileştirebileceğini öne sürmektedir [ 16 , 17 ]. miRNA’lar, transkripsiyon sonrası gen ekspresyonunu düzenleyen kodlamayan RNA molekülleridir [ 18 , 19 ]. Yumurtalık fonksiyonu, steroidogenez ve metabolik düzenleme dahil olmak üzere çeşitli biyolojik süreçlerdeki rolleri, PKOS için biyobelirteç ve terapötik hedef olarak potansiyel rollerine olan ilgiyi artırmıştır [ 20 ].Bu makale, PKOS’ta hücre dışı sıvılardaki mikroRNA’ların ekspresyonunu ve rolünü inceleyerek, tanısal potansiyellerini ve biyolojik önemlerini vurgulamaktadır. Aşağıdaki bölümlerde PKOS’un klinik özellikleri, mikroRNA’ların ekspresyonu, işlevi ve biyogenezisi ile yumurtalık fizyolojisi, insülin direnci ve hormonal regülasyondaki rolleri ele alınmaktadır. Ayrıca, hücre dışı sıvılardaki mikroRNA’ların PKOS için biyobelirteç olarak potansiyeli ve gelecekteki klinik uygulamalar için çıkarımları incelenmektedir.
2. Polikistik over sendromu
PKOS, düzensiz adet görme, kısırlık, hirsutizm, akne, gebelik sırasında oluşan komplikasyonlar, insülin direnci (IR), artmış kardiyovasküler risk, pre-diyabet, depresyon ve obezite gibi semptomlarla karakterizedir ve hacmi 10 mL’nin üzerinde olan en az bir yumurtalık ve 2 ila 9 mm boyutlarında en az on kist varlığıyla tanımlanır.
Tanı genellikle yalnızca saç dökülmesi veya kısırlık gibi komplikasyonlar ortaya çıktığında konur [ 2 ]. Rotterdam kriterleri, PCOS tanısı için standart bir çerçeve olarak yaygın olarak kabul görmüştür. Ulusal Sağlık Enstitüsü (NIH), bu kriterleri PCOS için geçerli tanı ölçütleri olarak onaylamıştır. Tıp uzmanları arasında, PCOS tanısının, aşağıdaki özelliklerden en az ikisinin ortaya çıkmasına göre konulması gerektiği konusunda bir fikir birliği vardır: yumurtalık kistleri, biyolojik hiperandrojenizm (artmış androjen seviyeleri) veya klinik hiperandrojenizm (hirsutizm, androjenik alopesi, akne veya virilizasyon gibi semptomlar) ve düzensiz adet döngüleri
PKOS’un kesin etiyolojisi tam olarak anlaşılamamıştır; ancak genetik yatkınlıklar ve stres, obezite ve hormonal değişiklikler gibi çevresel etkilerin gelişimine önemli ölçüde katkıda bulunduğu düşünülmektedir [ 5 ]. Tanı kriterleri tartışılırken, ultrason, pelvik muayeneler ve kan testleri PKOS’u doğrulayabilir [ 6 ]. PKOS tanısı tek bir teste dayanmaz. Aksine, sağlık hizmeti sağlayıcıları benzer semptomlar gösteren diğer tıbbi durumları dışlamalıdır ve kan testleri bu tanı yaklaşımının yalnızca bir bölümünü oluşturur.Bu kan testleri, 17-hidroksiprogesteron (17-OHP), anti-Müllerian hormonu (AMH), dehidroepiandrosteron sülfat (DHEA), östrojen, folikül uyarıcı hormon (FSH), luteinize edici hormon (LH), prolaktin, seks hormonu bağlayıcı globulin (SHBG), testosteron, tiroid uyarıcı hormon (TSH), triiyodotironin (T3) ve tiroksin (T4) dahil olmak üzere çeşitli hormon seviyelerini değerlendirir. PKOS tanısı artık 3’e 1’i aşan bir LH/FSH oranına dayanmamaktadır. PKOS’lu bireylerde genellikle yüksek LH seviyeleri bulunurken, diğer hormon profilleri normal olabilir. 17-OHP testi, PKOS semptomlarını taklit edebilen geç başlangıçlı konjenital adrenal hiperplaziyi ekarte eder. Yüksek testosteron yaygındır, ancak bazı kişiler normal androjen seviyeleriyle birlikte akne ve hirsutizm yaşayabilir. Androjen düzensizlikleri PKOS için gösterge niteliğindedir, ancak kesin değildir. Adet düzensizliklerinin nedeni olarak tiroid sorunlarını dışlamak için tiroid fonksiyon paneli yapılır. Tipik olarak SHBG seviyeleri düşüktür ve yüksek AMH seviyeleri, folikül olgunlaşmasını engelleyerek anovülasyona ve kısırlığa yol açarak PKOS’u düşündürür. Östrojen seviyeleri anormal olabilir ve artan prolaktin de oligomenore veya amenore gibi adet düzensizliklerine neden olabilir.
Bu kan testleri hormon seviyelerine odaklanarak doğru tanı için hassas ve spesifik biyobelirteçlere olan ihtiyacı vurgulamaktadır. Genetik bir bakış açısından, hormon seviyelerini erken aşamada tespit etmek önemli zorluklar ortaya koymaktadır. Tipik olarak, durum için güvenilir bir biyobelirteç bulmak için iki temel yaklaşım vardır. İlk yaklaşım, hastaların kan örnekleri veya foliküler sıvısı kullanılarak, iki ayrı gruptaki çeşitli RNA ve proteinleri karşılaştırmak için dizileme ve blotlama tekniklerinin uygulanmasını içerir. Bu karşılaştırmalı çalışma, en alakalı biyobelirteçleri belirlemeyi amaçlamaktadır. İkinci yaklaşım, sendromla bağlantılı bilinen bir kodlamayan RNA (ncRNA) biyobelirtecinin moleküler mekanizmalarını ve biyolojik önemini incelemeye odaklanmaktadır [ 34 , 35 ]. Biyobelirteçler üzerine yapılan araştırmalar, daha erken tespit, moleküler alt tipleme ve PCOS’un diğer hastalıklarla bağlantıları hakkında daha derin bilgi sağlayabilir. Çok sayıda araştırma incelemesi, PCOS teşhisi konmuş kadınların foliküler sıvısında miRNA’ları tespit etmiş ve bunların hem biyobelirteç hem de terapötik hedef olarak uygulanabilirliğini öne sürmüştür.
3. miRNA’lar
1993 yılında keşfedilen miRNA’lar, tipik olarak 19 ila 25 nükleotid uzunluğunda ve tek zincirli bir formda bulunan, endojen, küçük, kodlamayan bir RNA molekülü türüdür [ 18 , 36 ]. Eksik tamamlayıcılıkla hedef mRNA’nın 3′ çevrilmemiş bölgesine (UTR) bağlanarak transkripsiyon sonrası düzeyde gen ifadesi üzerinde negatif kontrol uygularlar. Bu süreç, çeviriyi engeller ve/veya mRNA dengesizleşmesine neden olur [ 19 ]. Çok hücreli organizmalarda evrimsel olarak korunan bu RNA molekülleri, önemlerini vurgular [ 37 ]. İnsan genomunun yaklaşık %1’i miRNA kodlayan dizilerden oluşur ve Homo sapiens’te yaklaşık 2.800 miRNA tanımlanmıştır [ 38 , 39 ]. Çok sayıda çalışma, miRNA’ların biyogenezini, işlevsel rollerini ve etki mekanizmalarını kapsamlı bir şekilde incelemiştir.
miRNA biyogenezisi süreci, RNA polimeraz II ve III’ün genomik DNA’dan birincil miRNA’yı (pri-miRNA) transkripsiyonunu kontrol ettiği çekirdekte başlar [ [41] , [42] , [43] ]. Bu süreç, genellikle yüzlerce nükleotid (nt) içeren uzun bir sap-ilmek saç tokası yapısı üretir [ 44 ]. Bu yapı, iki RNase III enzimi tarafından ardışık işleme tabi tutulur [ 45 , 46 ]. Drosha veya DCGR8 olarak adlandırılan ilk enzim, pri-miRNA’yı kesmek için birkaç başka proteinle işbirliği yaparak, 60 ila 110 nükleotid uzunluğunda, yeni oluşmuş saç tokası yapılı bir öncü miRNA (pre-miRNA) üretir. Daha sonra, exportin-5 (XPO5) pre-miRNA’yı çekirdekten sitoplazmaya aktarır [ [45] , [46] , [47] ]. Dicer-TRBP enzimi, pre-miRNA molekülünden döngüyü çıkarır ve bunun sonucunda bir kılavuz zincir ve bir yolcu zinciri içeren kısa bir miRNA çift zinciri oluşur [ 47 , 48 ]. Daha sonra, ‘yolcu’ zinciri olarak bilinen termodinamik olarak kararlı 5′ ucu, bilinmeyen bir mekanizma yoluyla parçalanır; ancak belirli koşullar altında işlevselliğini koruyabilir [ 48 ]. Kılavuz zincir, olgun bir miRNA oluşturmak üzere işleme tabi tutulur ve bu da daha sonra Argonaute ailesinden proteinle ilişki kurarak RNA kaynaklı susturma kompleksini (RISC) oluşturur [ 49 ]. Olgun miRNA’lar, RISC kompleksinin temel bir bileşeni olarak, belirli mRNA dizilerini belirleyerek gen ifadesini etkileyebilir. Tanımlama üzerine, AGO ailesi proteinleri, miRNA’nın tohum bölgesi (5′ ucundan 2 ila 8–9 bazlar) ile mRNA dizisinin 3’UTR’si arasındaki tamamlayıcılık derecesine bağlı olarak, mRNA’yı parçalamak veya çevirisini önlemek için endonükleaz aktivitelerini kullanırlar [ 49 , 50 ]. Daha fazla tamamlayıcılık genellikle çeviri inhibisyonu yerine mRNA bozulmasına yol açar [ 44 ]. Araştırmaya göre, miRNA’lar insan protein kodlayan genlerin yaklaşık yarısından fazlasını düzenlemekten sorumludur ve hücre döngüsü, çoğalma, farklılaşma, iltihaplanma, apoptoz, stres tepkisi, tümör metastazı, kök hücre bakımı, metabolizma ve hematopoez gibi kritik hücresel süreçleri etkiler [ 19 , 51 , 52 ]. Dahası, miRNA’lar hedefleri ve ürünleriyle geri bildirim düzenleyici süreçlere katılarak belirli sinyal yollarının inhibisyonunu veya geliştirilmesini kolaylaştırır. Sonuç olarak, az sayıda mikroRNA’nın ifadesindeki değişiklik, diyabet dahil ancak bununla sınırlı olmamak üzere çok sayıda hastalığa katkıda bulunma potansiyeline sahiptir [ 53], çeşitli nörolojik ve otoimmün durumlar [ 54 , 55 ], kardiyovasküler hastalıklar [
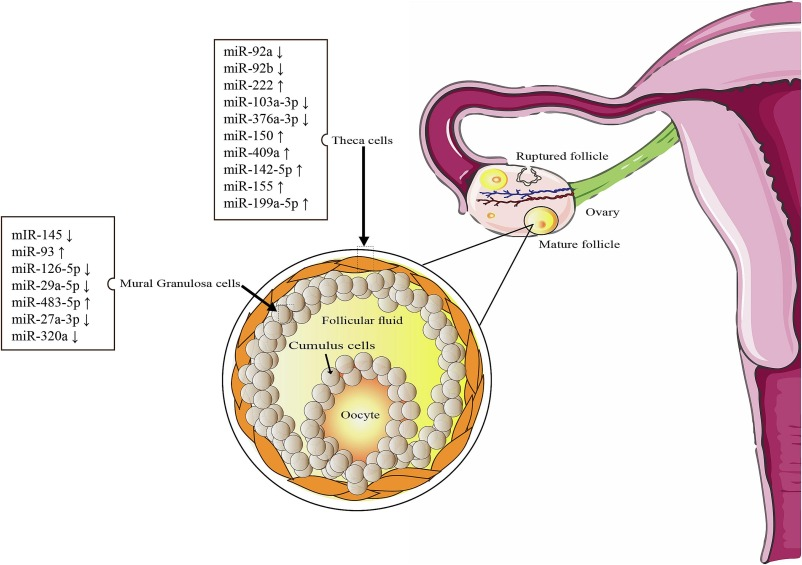
56 ] ve kanser [ 57 ]. Çeşitli kanserlerde tümör baskılayıcılar ve onkogenler olarak ikili roller göstermişlerdir [ 58 ].Giderek artan sayıda kanıt, miRNA’lar ile prematüre yumurtalık yetmezliği (POI), Asherman sendromu (AS) [ 59 ], endometriozis [ 60 ] , preeklampsi [ 61 ], rahim miyomları [ 53 ] , yumurtalık kanseri [ 62 ] , endometriyal kanser [ 63 ] ve serviks kanseri [ 64 ] gibi çok sayıda kadın üreme bozukluğu arasında güçlü bir korelasyon olduğunu ileri sürmektedir. Son araştırmalar, PCOS teşhisi konan kadınlar ile bu rahatsızlığı olmayan kadınlar arasındaki miRNA ekspresyon düzeylerinde farklılıklar olduğunu göstermiştir
Yazının tamamına erişmek için lütfen bağlantıya tıklayınız: https://www.sciencedirect.com/science/article/pii/S0009898125002839?via%3Dihub
Burada paylaşılmış olan bilgilerin ana makalesine aşağıda göz atabilirsiniz.
